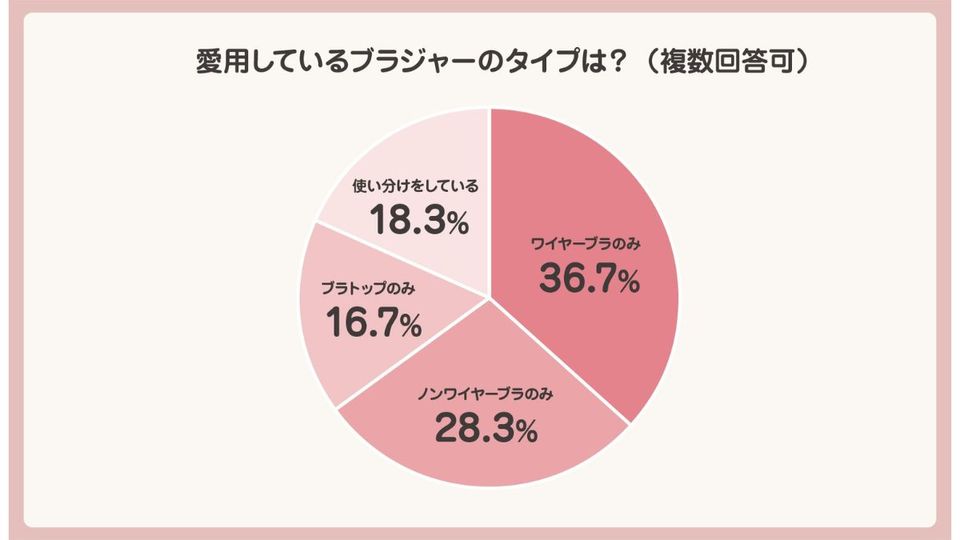
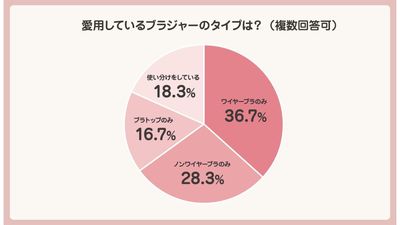
政府は5月31日、「紅麹関連製品への対応に関する関係閣僚会合」の第2回会合を開催。消費者庁が4月から開催していた「機能性表示食品を巡る検討会」の報告書の内容を踏まえ、機能性表示食品制度の見直しの方針を取りまとめた。
政府が取りまとめた方針では、機能性表示食品の届け出事業者に対して、①医師が診断した健康被害と疑われる情報を集め、因果関係が不明でもすぐに国に報告することを義務付ける ②安全で質の高い製品を作るための「適正製造規範(GMP)」に基づいた製造管理をすることを義務付ける ③消費者庁のホームページをDXし、消費者教育の強化を図るーーの主に3点を盛り込んだ。食品表示法に基づく内閣府令の「食品表示基準」で定めるとしている。
食品衛生法においては、施行規則を改正し、機能性表示食品の届け出事業者に対して、都道府県知事への情報提供を義務付ける。違反した場合は、営業の禁止・停止の行政措置が可能だとしている。
自見英子消費者担当大臣によると、今後、関係閣僚会合の取りまとめの内容は、消費者委員会への諮問や、パブリックコメントを経て、速やかに法整備するとしている。
トクホについても、「機能性表示食品を巡る検討会」の報告書の内容を踏まえ、医師の診断付き健康被害報告の義務化や、GMPの義務化など、機能性表示食品の見直しの方針と同等の措置をめざすとしている。
新規の機能性関与成分の届出については、届け出段階で確認を慎重に行う要件を食品表示基準に明記するとしている。安全性や機能性の専門家の意見を聞く仕組みなどの導入を検討するとしている。
検討会の報告書に盛り込まれた、「医薬品でない旨を表示する」といったことは、関係閣僚会合の方針には盛り込まれなかった。